
Q&A
プロウペスの安全性
Q1
国内臨床試験での副作用は?
A.
国内臨床試験1-4)における副作用は下表のとおりでした。
プロウペスによる重篤な副作用は、胎児機能不全心拍パターン1例(0.8%)でした。また、投与中止(除去)に至った副作用は、重度の胎児機能不全心拍パターン(投与後5時間32分でプロウペス除去)、中等度の胎児頻脈(投与後3時間11分でプロウペス除去)、重度の胎児心拍数異常(投与後1時間24分でプロウペス除去)各1例(計3例)でした。本試験では、副作用による死亡は認められませんでした。
過強陣痛と関連する子宮収縮異常や、胎児機能不全と関連する胎児機能不全心拍パターン、胎児一過性徐脈異常、胎児頻脈、胎児心拍数異常の副作用については、過強陣痛、胎児機能不全を参照ください。
表
副作用:全試験期間(併合安全性解析対象集団)5)
| 発現例数※(%) (n=125) |
|
|---|---|
| 副作用 | 11(8.8%) |
| 心臓障害 | 4(3.2%) |
| 胎児機能不全心拍パターン*、** | 2(1.6) |
| 胎児一過性徐脈異常** | 1(0.8%) |
| 胎児頻脈* | 1(0.8%) |
| 胃腸障害 | 2(1.6%) |
| 腹部膨満** | 1(0.8%) |
| 悪心* | 1(0.8%) |
| 一般・全身障害および投与部位の状態 | 2(1.6%) |
| 発熱* | 2(1.6%) |
| 発現例数※(%) (n=125) |
|
|---|---|
| 臨床検査 | 2(1.6%) |
| 血圧上昇* | 1(0.8%) |
| 胎児心拍数異常* | 1(0.8%) |
| 代謝および栄養障害 | 1(0.8%) |
| 代謝性アシドーシス** | 1(0.8%) |
| 妊娠、産褥および周産期の状態 | 2(1.6%) |
| 妊娠高血圧** | 1(0.8%) |
| 子宮収縮異常** | 1(0.8%) |
| 生殖系および乳房障害 | 1(0.8%) |
| 子宮出血** | 1(0.8%) |
※:261試験及び262試験のプロウペス群の合計(261試験の症例を*、262試験の症例を**で表示)
MedDRA/J Ver 21.0
Q2
CTG異常の発現時期は?
A.
国内臨床試験におけるCTG異常(胎児機能不全心拍パターン、胎児一過性徐脈異常、胎児頻脈、胎児心拍数異常)の発現時期については、胎児機能不全を参照ください。海外臨床試験6)において、CTG関連事象の発現率は27.1%(118/436例)、発現時期の中央値(95%範囲)は5.5時間(4.2‒6.6)で、胎児機能不全及び子宮収縮の発現時期のピークは投与から2~8時間後でした(下図)。しかし、発現時期に傾向がみられないため、プロウペス投与中は連続モニタリングを行ってください。
図
プロウペス投与中におけるCTG異常(有害事象)の発現時期(海外データ)6)
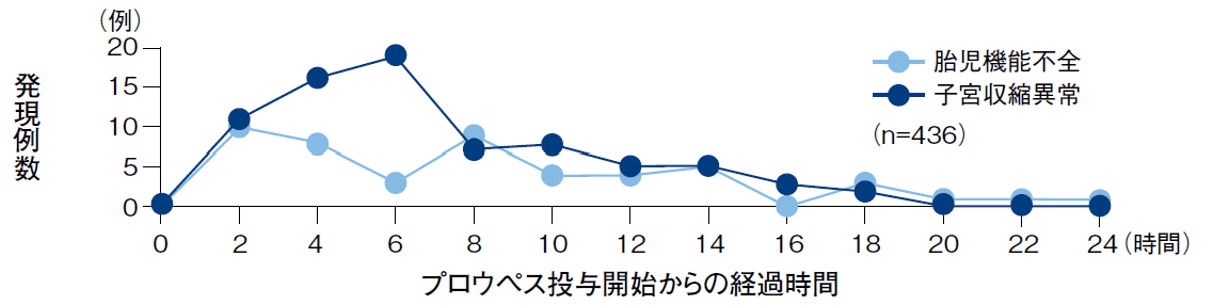
胎児機能不全:胎児徐脈(110拍/分未満)、胎児頻脈(160拍/分超)、原因不明な5-15拍/分の変動、早発性徐脈等
子宮収縮異常:胎児心拍数異常及び/又は胎児アシドーシスを伴う子宮頻収縮又は過強収縮
【海外事後解析6)】
| 対象 | 分娩誘発前に子宮頸管熟化の処置を必要とする(妊娠36週以上※、改訂ビショップスコア4点以下、単胎妊娠)妊婦1,308例(Misoprostol*腟内留置用製剤(MVI)100μg群428例、MVI50μg群444例、プロウペス群436例) |
|---|---|
| 方法 | MVI100μg又は、50μg又は、プロウペスに無作為に割り付け、最長24時間投与※した。 |
| 評価項目 | 各製剤投与中のCTG異常の発現率及び発現時期、CTG異常に伴う帝王切開の割合及び時期 |
| 解析計画 | 連続データの正規性はShapiro-Wilk検定を用いた。正規分布データは分散分析及びStudent’s t検定、非正規分布データはKruskal-Wallis順位和検定を用いた。カテゴリー変数はχ2検定又はFisher’s exact検定を用いて解析した。 |
| *本邦で承認されている効能又は効果に分娩誘発は含まれない | |
|---|---|
| ※本邦で承認されているプロウペスの効能又は効果 | 妊娠37週以降の子宮頸管熟化不全における熟化の促進 |
| 用法及び用量 | 本剤1個を後腟円蓋に挿入し、最長12時間腟内に留置する。 |
引用文献6)より作図
Q3
プロウペス除去後の回復時間は?
A.
国内臨床試験におけるプロウペス除去後の回復時間については、胎児機能不全を参照ください。海外臨床試験7)において、プロウペス除去に至った有害事象は4.0%(27/680例)に認められ、除去から回復までの時間(中央値)は47分でした。また、主な有害事象は胎児心拍数異常を伴う過強陣痛1.2%(8/680例)、胎児心拍数異常パターンⅡ/Ⅲ(ACOGカテゴリー)1.9%(13/680例)に認められ、除去から回復までの時間(中央値)はそれぞれ8分30秒、1時間27分でした。
表
プロウペス除去例における除去までの時間と除去後の回復時間(海外データ)7)
| 発現率(例数) (n=680) |
投与から除去までの 時間(中央値) |
除去から回復までの 時間(中央値) |
|
|---|---|---|---|
| プロウペス除去に至った有害事象 | 4.0(27例) | 9時間41分 | 47分 |
| 胎児心拍数異常を伴う過強陣痛 | 1.2(8例) | - | 8分30秒 |
| 胎児心拍数異常パターンⅡ/Ⅲ (ACOGカテゴリー) |
1.9(13例) | - | 1時間27分 |
安全性:プロウペス群の主な有害事象は胎児心拍数異常パターンⅡ/Ⅲ(ACOGカテゴリー)13例、胎児心拍数異常を伴う過強陣痛8例であった。MVI単回腟挿入群の主な有害事象は、胎児心拍数異常を伴う過強陣痛36例、胎児心拍数異常Ⅱ/Ⅲ(ACOGカテゴリー)22例であった。他に胎児心拍数異常を伴わない過強陣痛が2例報告されているが、回復時間等が明記されておらず表には組み込んでいない。
【海外事後解析7)】
| 対象 | 分娩誘発が必要な(妊娠36週以上※、改訂ビショップスコア4点以下、18歳以上)妊婦1,358例〔Misoprostol*腟内留置用製剤(MVI)群678例、プロウペス群680例〕 |
|---|---|
| 方法 | MVI群とプロウペス群の2群に無作為に割り付け、最長24時間投与※した。 |
| 評価項目 | 薬剤除去に至った有害事象、有害事象消失までの時間 等 |
| 解析計画 | 薬剤除去に至った有害事象はFisher’s exact検定、有害事象の発現と消失までの時間はWilcoxon順位和検定により解析した。 |
| *本邦で承認されている効能又は効果に分娩誘発は含まれない | |
|---|---|
| ※本邦で承認されているプロウペスの効能又は効果 | 妊娠37週以降の子宮頸管熟化不全における熟化の促進 |
| 用法及び用量 | 本剤1個を後腟円蓋に挿入し、最長12時間腟内に留置する。 |
引用文献7)より作表
Q4
プロウペスの感染症のリスクは?
A.
プロウペスの感染症リスクについて、参考情報として、ジノプロストン経腟製剤を含む薬剤的子宮頸管熟化処置は、器械的子宮頸管熟化処置と比べ母体感染症のリスクが同程度8)又は少ない9)との報告があります。プロウペスは後腟円蓋に投与するため、一般的に内診による感染症のリスクと同程度と考えられます。
表
感染症の発症率とオッズ比(海外データ)9)
| 器械的子宮頸管熟化処置 全体 (n=2,220) |
薬剤的子宮頸管熟化処置※ (n=2,2248) |
オッズ比(95%CI) | |
|---|---|---|---|
| 母体感染症 | 11.4(252例) | 8.4(188例) | 1.38(1.12-1.68) |
※ジノプロストン経腟製剤以外(Misoprostol*及びHyaluronidase#)も含む
*本邦で承認されている効能又は効果に分娩誘発は含まれない
#本邦未承認
【システマティックレビュー9)】
| 対象 | 1966年1月から2005年11月までに文献化され、子宮頸管熟化剤と器械的子宮頸管熟化処置のランダム化比較試験(30試験)に登録された妊婦 |
|---|---|
| 方法 | 子宮頸管熟化剤と器械的子宮頸管熟化処置の有効性と安全性を検討したランダム化比較試験を複数のデータベースより抽出し、母体感染症、絨毛膜羊膜炎、子宮内膜炎及び、新生児感染症の発症リスクについて薬剤的子宮頸管熟化処置に対する器械的子宮頸管熟化処置のオッズ比(OR)を用いて検討した。 |
| 評価項目 | 子宮頸管熟化剤と器械的子宮頸管熟化処置における母体感染症、絨毛膜羊膜炎、子宮内膜炎及び、新生児感染症との関連 |
| 解析計画 | ORは、固定効果(Mantel-Haenszel)モデルとランダム効果(DerSimonian and Laird)モデルを用いて評価した。各試験の不均質性は、Breslow-Day法を用いて検定し、L'Abbeプロットの定性的目視検査によって評価した。 |
引用文献9)より作表
Q5
プロウペスの胎児及び授乳への影響は?
A.
プロウペスの子宮収縮作用により過強陣痛が生じた場合には胎児機能不全のおそれがあるため、プロウペス投与中は分娩監視装置を用いた連続モニタリングを実施してください。なお、海外臨床試験において10)プロウペスは胎児の中大脳動脈、腎動脈、胎児静脈管及び臍帯動脈の抵抗係数に影響を与えなかったとの海外報告があります。
また、プロウペスの投与により出産した児における授乳については、乳汁中へのジノプロストンの移行を検討した薬物動態試験は行っていませんが、日本人健康成人女性に12時間留置した際の最大血漿中ジノプロストン濃度(Cmax、幾何平均値)は2.6pg/mLであり11)、ジノプロストンの代謝は数分であり母乳への移行は極めて少ないと想定します。なお、一般的な日本人の母乳中のプロスタグランジンE2量として平均279pg/mLとの報告12)があります。
1)社内資料:国内多施設共同非盲検第Ⅲ相試験(261試験)[承認時評価資料]
2)伊東宏晃他:産科と婦人科. 2021: 88(4); 505-514.[フェリング依頼臨床試験]
3) 社内資料:国内多施設共同無作為化二重盲検プラセボ対照第Ⅲ相試験(262試験)[承認時評価資料]
4)Itoh H. et al.:J Obstet Gynaecol Res. 2021: 47(1); 216-225.[フェリング依頼臨床試験]
5)社内資料:国内第Ⅲ相試験の併合解析(261試験及び262試験)[承認時評価資料]
6)Pevzner L. et al.:Eur J Obstet Gynecol Reprod Biol. 2011: 156(2); 144-148.
7)Rugarn O. et al.:BJOG. 2017: 124(5); 796-803.[フェリング依頼臨床試験]
8)Jozwiak M, et al.: Eur J Obstet Gynecol Reprod Biol. 2013: 170(1); 137-145.
9)Heinemann J. et al.: Am J Obstet Gynecol. 2008: 199(2); 177-187.
10)Fok WY. et al.: J Reprod Med. 2005: 50(9); 697-700.
11)社内資料:健康成人女性における薬物動態、安全性及び忍容性 [承認時評価資料]
12)古賀民穂他:日油化学会誌. 2000: 49(2); 157-161.



