
製品概要
国内多施設共同無作為化二重盲検プラセボ対照第Ⅲ相試験(262試験、検証試験)1、2)
社内資料:国内多施設共同無作為化二重盲検プラセボ対照第Ⅲ相試験(262試験)[承認時評価資料]
Itoh H. et al.: J Obstet Gynaecol Res.2021: 47(1);216-225.[フェリング依頼臨床試験]
| 目的 | 子宮頸管熟化が必要な妊娠末期の妊婦(妊娠41週、ビショップスコアが4点以下)を対象にプロウペス1個を最長12時間腟内に留置したときの子宮頸管熟化促進における有効性及び安全性をプラセボと比較し評価する。 | ||||
|---|---|---|---|---|---|
| デザイン | 多施設共同、無作為化、二重盲検、プラセボ対照試験 | ||||
| 対象 | 子宮頸管熟化が必要な妊娠末期の妊婦(妊娠41週0日以上6日以下、ビショップスコアが4点以下)113例(本剤:57例、プラセボ:56例) | ||||
| 方法 | 対象を1:1の割合で無作為化後、本剤(ジノプロストン10mg含有)又はプラセボ1個を後腟円蓋の高い位置に横向きになるように挿入し、投与後少なくとも30分間は臥位で安静にさせ、最長12時間腟内に留置した。投与後3、6、9及び12時間にビショップスコアを評価し、投与12時間後に本剤又はプラセボを除去した。分娩データ、新生児所見、出産データを記録し、胎児娩出後から退院するまで、安全性について経過観察を行った。 | ||||
| 主要評価項目 | 子宮頸管熟化成功(投与後12時間以内にビショップスコアが7点以上又は経腟分娩のいずれかに至った場合)の割合 | ||||
| 副次評価項目 |
|
||||
| 探索的評価項目 | 投与後3、6、9及び12時間時点にビショップスコアが7点以上又は経腟分娩のいずれかに至った割合 | ||||
| 解析計画 | 全ての有効性評価項目の統計解析には、両側95%信頼区間(CI)を使用し、最大の解析対象集団(FAS)に基づいて行った。主要評価項目及び副次評価項目は、ベースラインのビショップスコアを共変量、時点(本剤/プラセボ投与後3、6、9、12時間)を固定効果とした反復測定の共分散分析モデルを用いて解析し、感度分析としてFisherの正確検定による解析も行った。審査の過程において、主要評価項目及び副次評価項目(初産婦及び経産婦の子宮頸管熟化成功の割合、投与後12時間以内に経腟分娩に至った割合、投与後12時間時点におけるビショップスコアがベースラインから3点以上増加した割合)は、評価指標及び評価項目の特性からFisherの正確検定による解析がより適切と考えられたため、Fisherの正確検定による解析結果を試験結果として示す。また、副次評価項目の本剤又はプラセボ除去後から胎児娩出までに子宮収縮薬を使用した割合とその投与量、並びに器械的頸管熟化処置を実施した割合とその処置時間は、投与群、出産歴、ベースラインのビショップスコアを固定効果とした分散分析モデルを用いた。 主要評価項目において、本剤とプラセボの子宮頸管熟化成功割合の差の両側95%CIの下限が0を超えた場合、プラセボに対する本剤の優越性が示されることとした。また、一部の副次評価項目(初回入院期間中の投与からアクティブな分娩開始までの時間、初回入院期間中の投与から経腟分娩、帝王切開及びあらゆる分娩様式での分娩までの時間、本剤/プラセボ除去後に器械的頸管熟化処置を実施した妊婦における処置時間)は固定効果として治療群及び層別因子を用い、比例ハザードモデルを用いて解析し、Kaplan-Meier曲線及びプロットを用いて記述的に示した。 |
患者背景、ベースラインのビショップスコア評価(FAS)
| プロウペス(n=57) | プラセボ(n=56) | ||
|---|---|---|---|
| 年齢(歳)、平均値±標準偏差 | 31.5±5.36 | 32.6±5.62 | |
| BMI(kg/㎡)、平均値±標準偏差 | 26.92±5.52 | 27.54±4.03 | |
|
初産婦 経産婦 出産回数 |
1回/2回/3回 |
47(82.5) 10(17.5) 7/2/1 |
44(78.6) 12(21.4) 10/2/0 |
| 分娩誘発の主な理由 | 過期産予防 | 57(100) | 56(100) |
| 推定在胎期間(日)、平均値±標準偏差 | 288.5±1.38 | 288.7±1.52 | |
| ビショップスコア合計スコア | 0〜2 | 30(52.6) | 29(51.8) |
| 3〜4 | 27(47.4) | 27(48.2) | |
| 子宮口開大度 | 0㎝ | 12(21.1) | 15(26.8) |
| 1〜2㎝ | 43(75.4) | 41(73.2) | |
| 3〜4㎝ | 2(3.5) | 0 | |
| 頸管展退度 | 0〜30% | 29(50.9) | 31(55.4) |
| 40〜50% | 28(49.1) | 24(42.9) | |
| 60〜70% | 0 | 1(1.8) | |
| 児頭の位置 | -3 | 45(78.9) | 44(78.6) |
| -2 | 10(17.5) | 12(21.4) | |
| (-1、0) | 2(3.5) | 0 | |
| 子宮頸部の硬度 | 硬 | 21(36.8) | 22(39.3) |
| 中 | 34(59.6) | 31(55.4) | |
| 軟 | 2(3.5) | 3(5.4) | |
| 子宮口の位置 | 後方 | 50(87.7) | 47(83.9) |
| 中央 | 7(12.3) | 8(14.3) | |
| 前方 | 0 | 1(1.8) | |
例数(%)
子宮頸管熟化成功割合<主要評価項目>
子宮頸管熟化成功割合(95%CI)は、プロウペス群が47.4%(34.0-61.0)であり、プラセボ群の14.3%(6.4-26.2)に比べ有意に多かった(p=0.0002、Fisherの正確検定)。
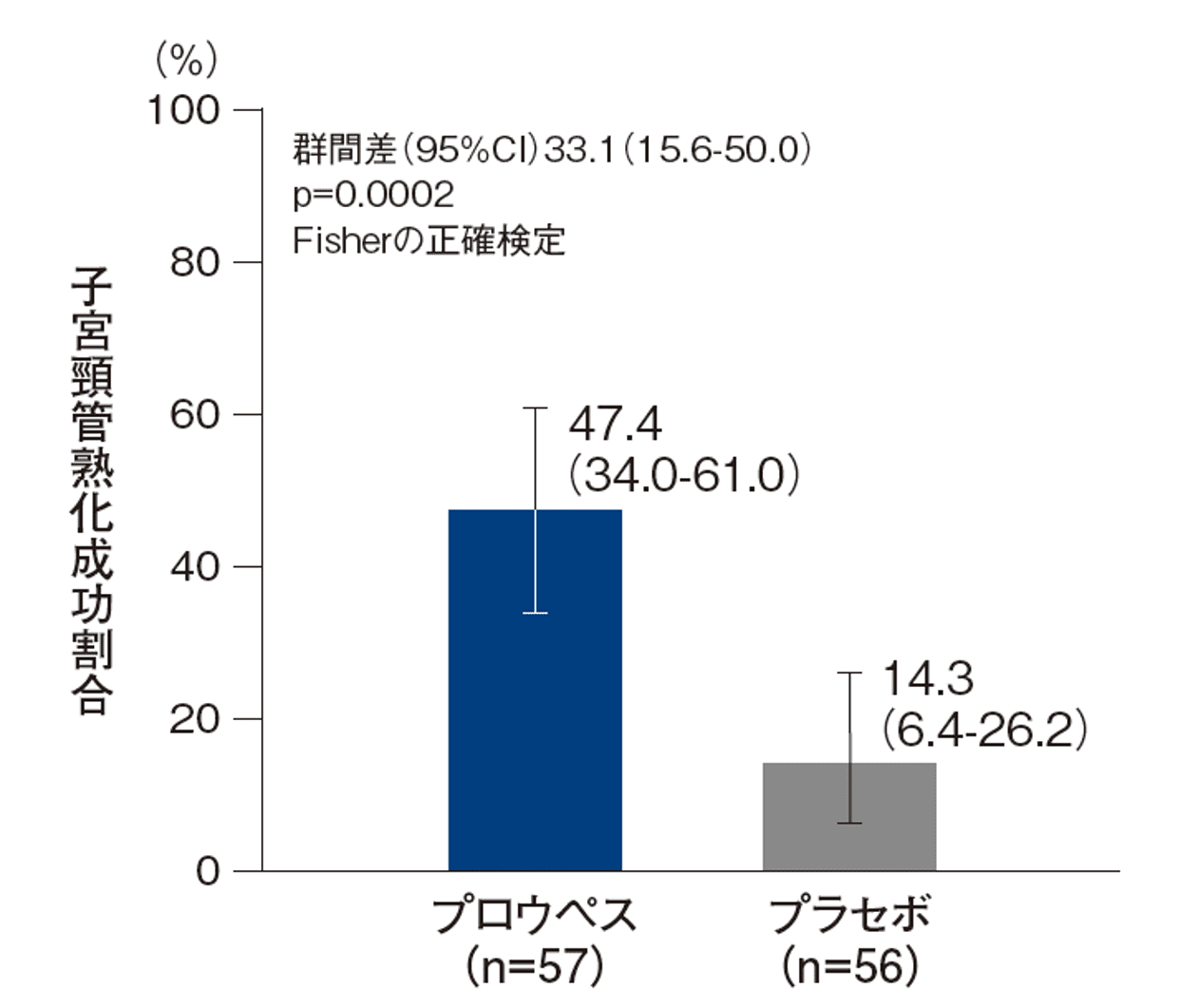
子宮頸管熟化成功の定義:投与後12時間以内にビショップスコアが7点以上又は経腟分娩のいずれかに至った場合
<副次評価項目>
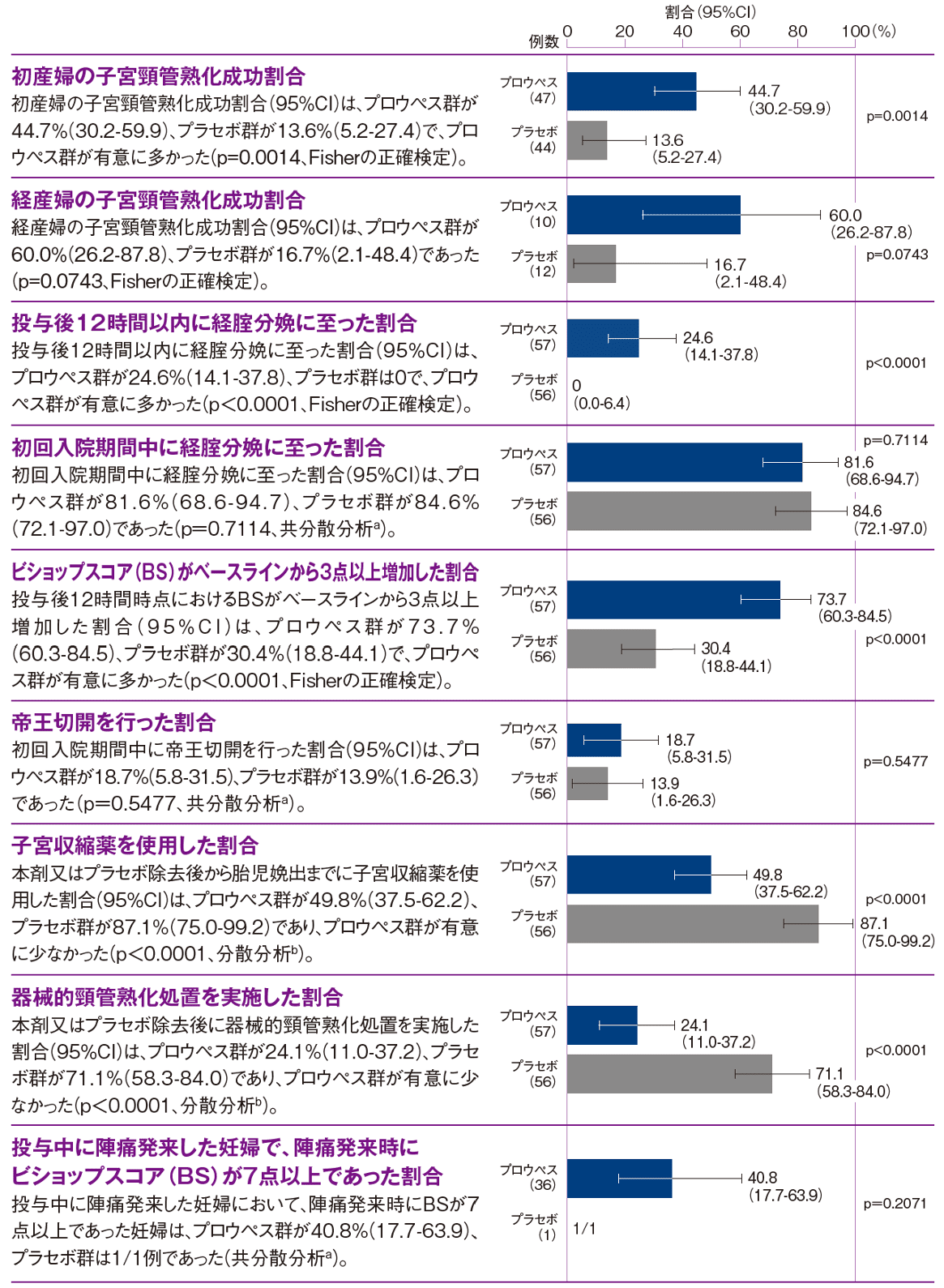
a:ベースラインのBSを共変量、投与群、出産歴(初産婦、経産婦)、ベースラインのBS(≦2、≦3)を固定効果とした共分散分析モデル
b:投与群、出産歴(初産婦、経産婦)、ベースラインのBS(≦2、≦3)を固定効果とした分散分析モデル
【帝王切開を行った理由】
帝王切開を行った妊婦は全体では22.1%(25/113例:プロウペス群14例、プラセボ群11例)であった。帝王切開を行った理由は有害事象の発現で、その内訳は、胎児機能不全心拍パターン(プロウペス群7例、プラセボ群3例)、分娩停止(プロウペス群2例、プラセボ群4例)、分娩過程停止(プロウペス群3例、プラセボ群4例)、分娩誘発不成功(プロウペス群1例)、羊膜腔感染(プロウペス群1例)であった。プロウペス群の胎児機能不全心拍パターンの1例を除き、いずれの事象も本剤又はプラセボとの因果関係は否定された。
【子宮収縮薬の投与量】
本剤又はプラセボ除去後から胎児娩出までに使用されたオキシトシンの投与量(調整平均値)は、プロウペス群2.52U、プラセボ群4.90Uで、投与群間差は-2.37U〔95%CI(-4.58--0.17)〕であり、プロウペス群の投与量は統計的に有意に少なかった(p=0.0355、分散分析モデルb)。PGF2αの投与量(調整平均値)は、プロウペス群7.00mg、プラセボ群3.63mgで、投与群間差は3.37mg〔95%CI(-1.52-8.26)〕であり、両群間に統計的な有意差は認められなかった(p=0.1285、分散分析モデルb)。
| 子宮収縮薬 | 例数 | 投与量(mg) 調整平均値(95%CI) |
プラセボとの群間差 (95%CI) |
p値b |
|---|---|---|---|---|
| オキシトシン(U) プロウペス プラセボ |
30 51 |
2.52(0.44-4.61) 4.90(3.31-6.49) |
-2.37(-4.58 - -0.17) |
0.0355 |
| PGE2(mg) プラセボ |
4 |
6.75(3.57-9.93) |
― | ― |
| PGF2α(mg) プロウペス プラセボ |
5 3 |
7.00(2.77-11.23) 3.63(0.00-10.10) |
3.37(-1.52 - 8.26) |
0.1285 |
b:投与群、出産歴(初産婦、経産婦)、ベースラインのBS(≦2、≦3)を固定効果とした分散分析モデル
【器械的頸管熟化処置時間】
本剤又はプラセボ除去後に器械的頸管熟化処置を実施した妊婦における器械的頸管熟化処置時間〔調整平均値(95%CI)〕は、プロウペス群(14例)が6.68時間(2.79-10.57)、プラセボ群(40例)が11.90時間(9.40-14.40)であり、プロウペス群が有意に短かった(p=0.0154、分散分析モデルb)。
b:投与群、出産歴(初産婦、経産婦)、ベースラインのBS(≦2、≦3)を固定効果とした分散分析モデル
初回入院期間中の本剤又はプラセボ投与からアクティブな分娩開始までの時間<副次評価項目>
初回入院期間中の本剤又はプラセボ投与からアクティブな分娩開始までの時間〔中央値(95%CI)〕は、プロウペス群が12.15時間(9.08-22.42)、プラセボ群が29.33時間(27.70-33.92)であり、プロウペス群が有意に短かった(p<0.0001、比例ハザードモデル)。プロウペス群の75%が投与から25.20時間以内、プラセボ群では54.25時間以内にアクティブな分娩開始を認めた。
初回入院期間中の本剤又はプラセボ投与からアクティブな分娩開始までの時間(Kaplan-Meier解析)(FAS)
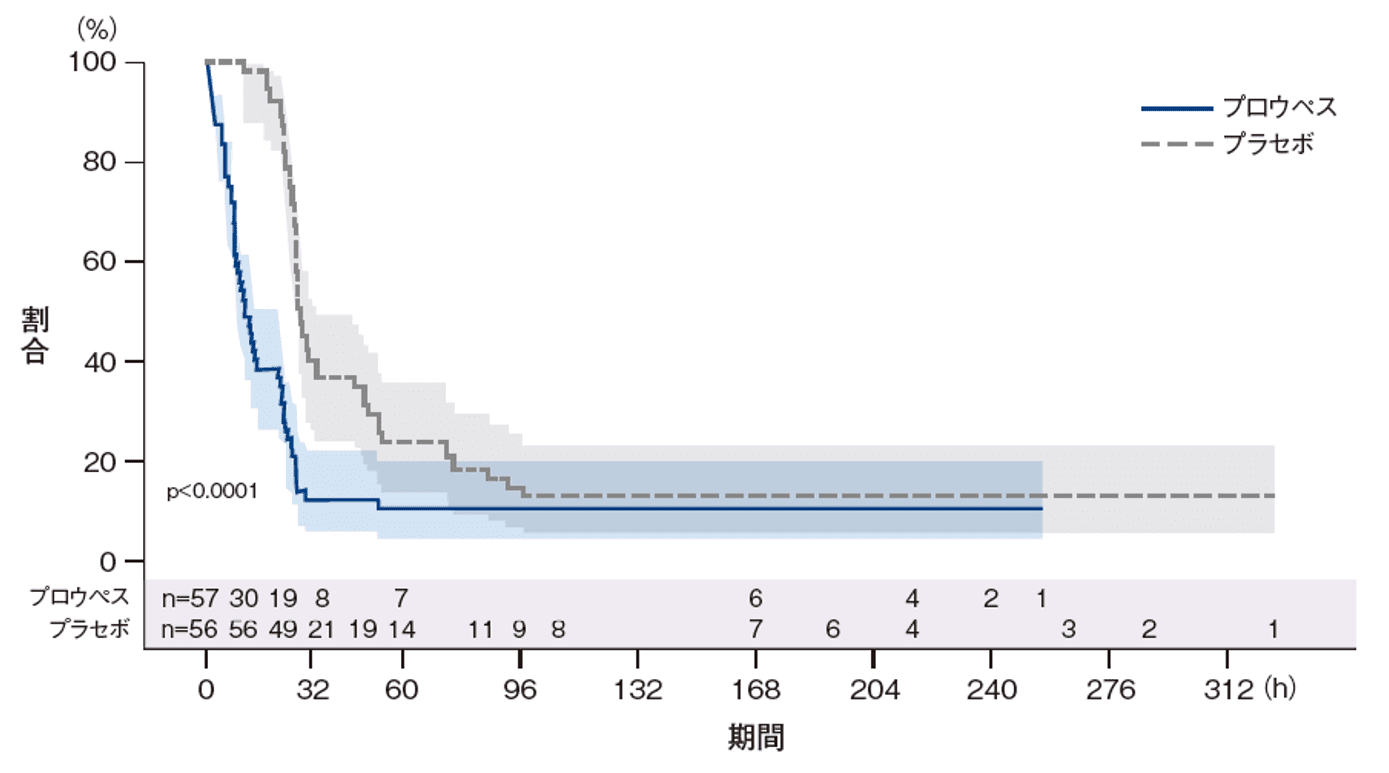
ハザード比(95%CI): 2.5252(1.6791-3.7977)
p<0.0001、治療群及び層別因子を固定効果とした比例ハザードモデル
アクティブな分娩:子宮頸管の熟化にかかわらず、30分間にわたり規則的で明らかな痛みを伴う3分間隔の子宮収縮がある場合
初回入院期間中の本剤又はプラセボ投与から経腟分娩までの時間<副次評価項目>
初回入院期間中の本剤又はプラセボ投与から経腟分娩までの時間〔中央値(95%CI)〕は、プロウペス群が26.18時間(16.30-28.83)、プラセボ群が33.02時間(31.13-53.07)であり、プロウペス群が有意に短かった(p=0.0009、比例ハザードモデル)。プロウペス群の75%が投与から33.80時間以内、プラセボ群では76.93時間以内に経腟分娩に至った。
初回入院期間中の本剤又はプラセボ投与から経腟分娩までの時間(Kaplan-Meier解析)(FAS)
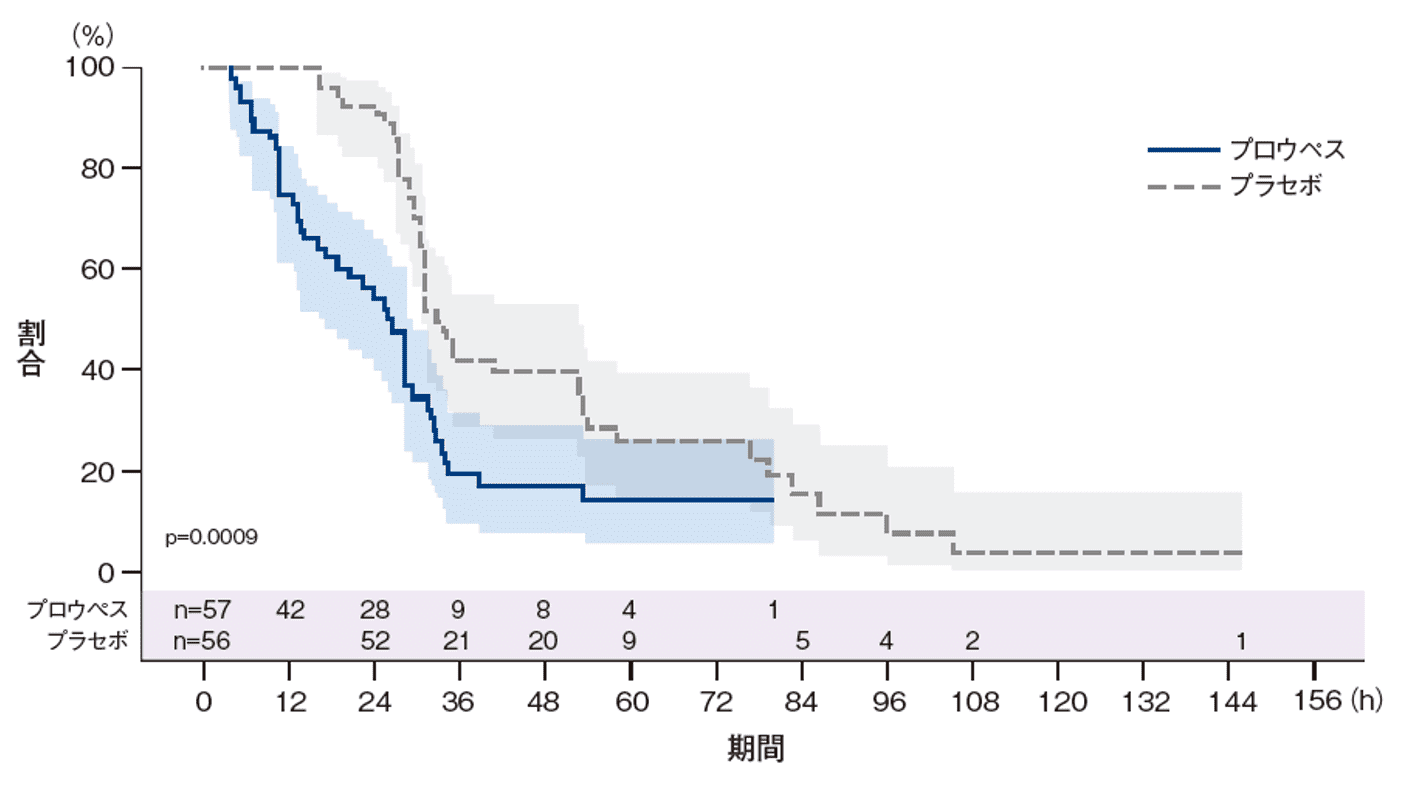
ハザード比(95%CI): 2.5075(1.6033-3.9215)
p=0.0009、治療群及び層別因子を固定効果とした比例ハザードモデル
初回入院期間中の本剤又はプラセボ投与から帝王切開までの時間<副次評価項目>
初回入院期間中の本剤又はプラセボ投与から帝王切開までの時間〔中央値(95%CI)〕は、プロウペス群が58.23時間(35.40-79.40)、プラセボ群が81.12時間(54.82-145.83)であり、プロウペス群が有意に短かった(p=0.0025、比例ハザードモデル)。
初回入院期間中の本剤又はプラセボ投与から帝王切開までの時間(Kaplan-Meier解析)(FAS)
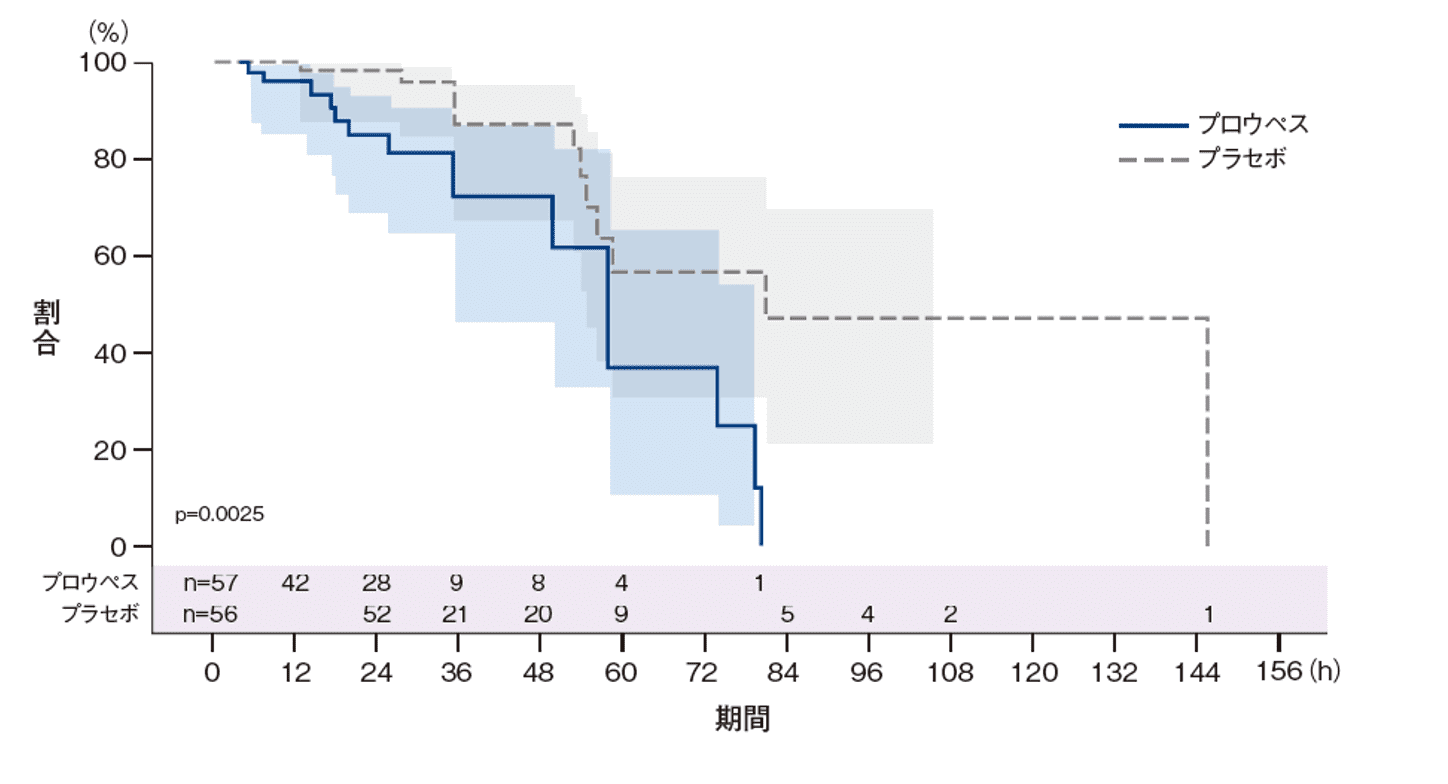
ハザード比(95%CI): 3.8429(1.6065-9.1923)
p=0.0025、治療群及び層別因子を固定効果とした比例ハザードモデル
初回入院期間中の本剤又はプラセボ投与からあらゆる分娩様式での胎児娩出までの時間<副次評価項目>
初回入院期間中の本剤又はプラセボ投与からあらゆる分娩様式での胎児娩出までの時間〔中央値(95%CI)〕は、プロウペス群が21.12時間(14.18-28.45)、プラセボ群が31.60時間(30.85-35.50)であり、プロウペス群が有意に短かった(p<0.0001、比例ハザードモデル)。プロウペス群の75%が投与から32.03時間以内、プラセボ群では53.95時間以内に出産した。
初回入院期間中の本剤又はプラセボ投与からあらゆる分娩様式での胎児娩出までの時間(Kaplan-Meier解析)(FAS)
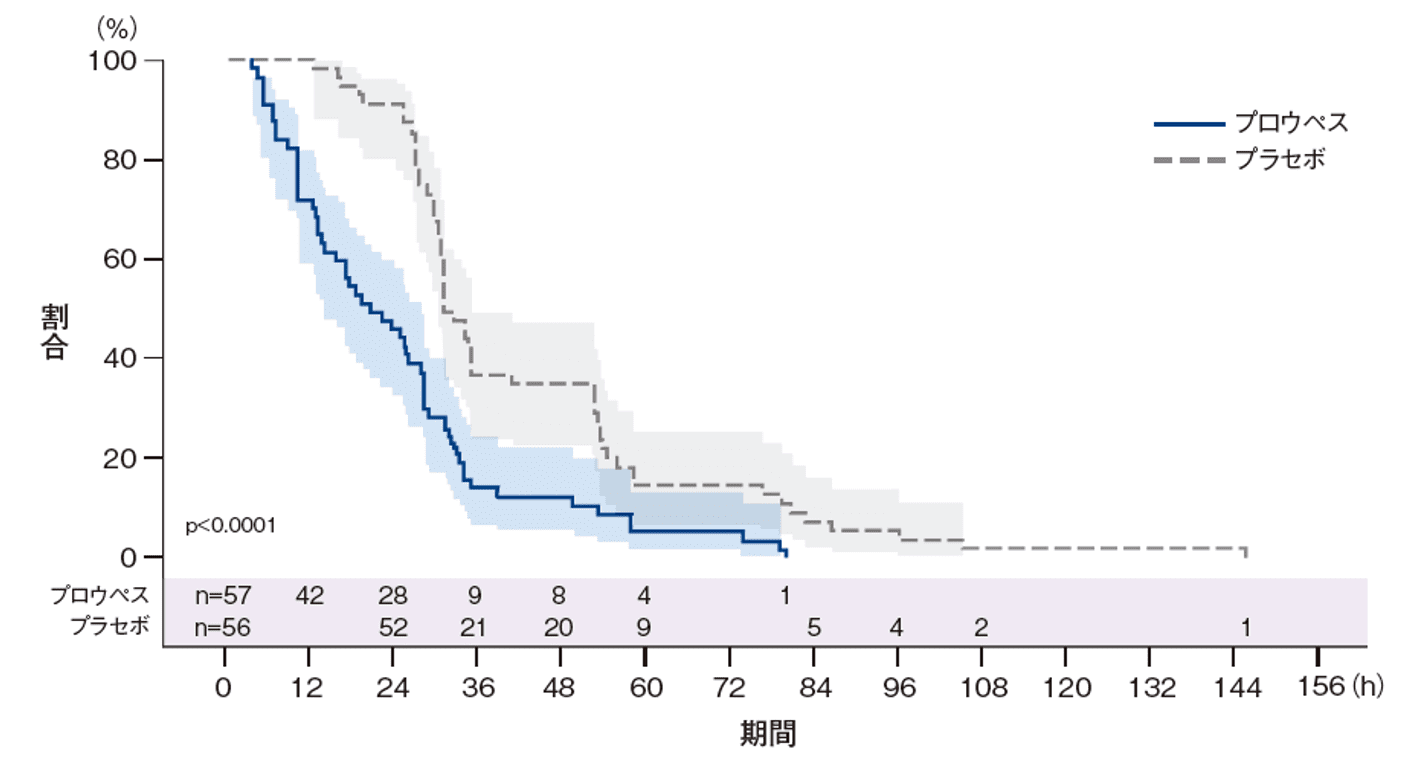
ハザード比(95%CI): 2.7201(1.8310-4.0411)
p<0.0001、治療群及び層別因子を固定効果とした比例ハザードモデル
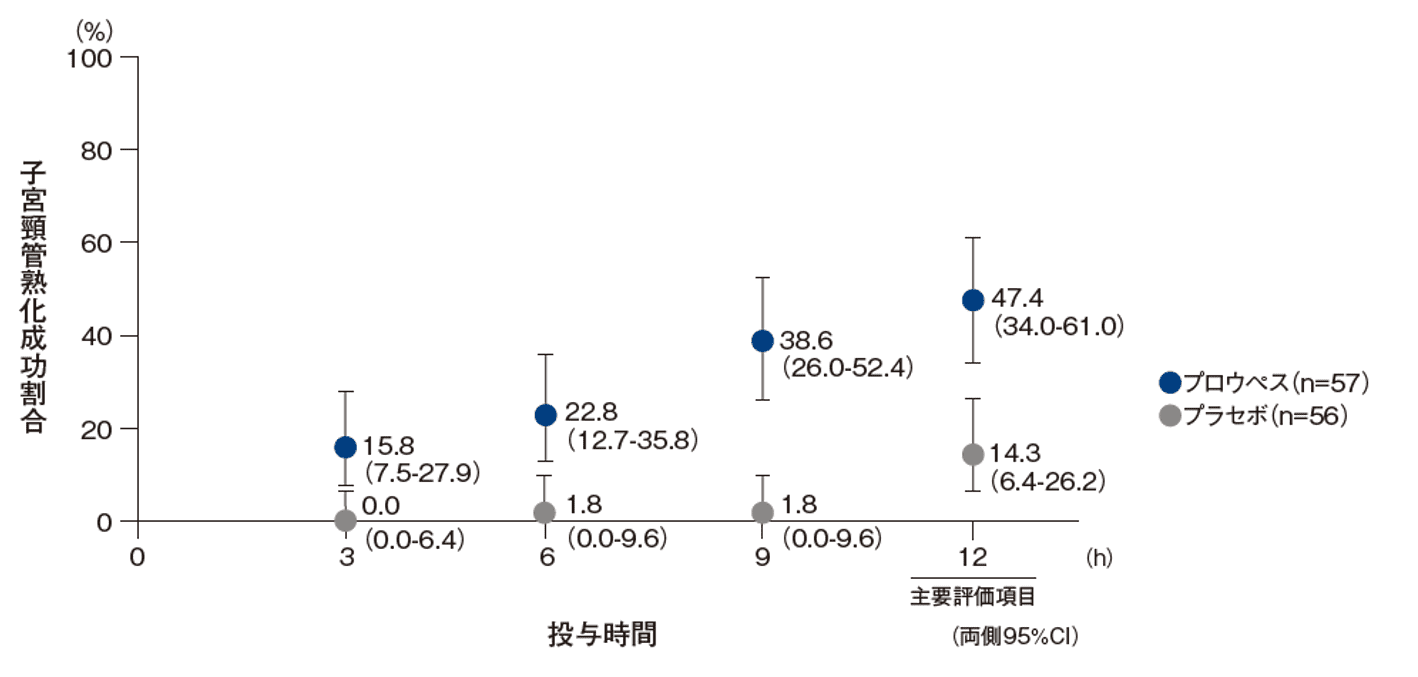
投与後3、6、9及び12時間時点にビショップスコアが7点以上又は経腟分娩のいずれかに至った割合<探索的評価項目>
投与後3、6、9及び12時間時点にビショップスコアが7点以上又は経腟分娩のいずれかに至った割合(95%CI)は、プロウペス群ではそれぞれ15.8%(7.5-27.9)、22.8%(12.7-35.8)、38.6%(26.0-52.4)、47.4%(34.0-61.0)、プラセボ群では、それぞれ0.0%(0.0-6.4)、1.8%(0.0-9.6)、1.8%(0.0-9.6)、14.3%(6.4-26.2)であった。プロウペス群とプラセボ群との間にいずれの時点においても有意差が認められた(それぞれ、p=0.0028、0.0009、<0.0001、0.0002、Fisherの正確検定)。
<安全性>
投与時間(平均値±標準偏差)はプロウペス群8.78±3.484h、プラセボ群11.63±1.432hであった。
副作用
全試験期間を通じて、副作用はプロウペス群で57例中5例(8.8%)に認められ、腹部膨満、妊娠高血圧、子宮収縮異常、子宮出血、胎児一過性徐脈異常、胎児機能不全心拍パターン及び代謝性アシドーシスが各1例(1.8%)であった。
重篤な副作用は1例(1.8%)に認められ、胎児機能不全心拍パターンであった。プラセボ群では副作用は認められなかった。試験期間を通して試験中止に至った有害事象は認められず、また妊婦、胎児及び新生児に死亡は認められなかった。
副作用:全試験期間(安全性解析対象集団)
| プロウペス(n=57) | |
| 副作用 | 5(8.8) |
|---|---|
| 心臓障害 | 2(3.5) |
| 胎児一過性徐脈異常 | 1(1.8) |
| 胎児機能不全心拍パターン | 1(1.8) |
| 胃腸障害 | 1(1.8) |
| 腹部膨満 | 1(1.8) |
| 代謝及び栄養障害 | 1(1.8) |
| 代謝性アシドーシス | 1(1.8) |
| 妊娠、産褥及び周産期の状態 | 2(3.5) |
| 妊娠高血圧 | 1(1.8) |
| 子宮収縮異常 | 1(1.8) |
| 生殖系及び乳房障害 | 1(1.8) |
| 子宮出血 | 1(1.8) |
例数(%)
MedDRA/J Ver 21.0
1)社内資料:国内多施設共同無作為化二重盲検プラセボ対照第Ⅲ相試験(262試験)[承認時評価資料]
2)Itoh H. et al.: J Obstet Gynaecol Res.2021: 47(1);216-225.[フェリング依頼臨床試験]



